<!--[endif]-->
MORFOLOGÍA DEL TEJIDO ADIPOSO: CONCEPTOS BÁSICOS
MODELOS IN VITRO DE DIFERENCIACIÓN DE ADIPOCITOS
Los procesos implicados en la
diferenciación de los precursores adipocitarios hasta adipocitos
maduros han
sido ampliamente estudiados utilizando modelos celulares in vitro. Éstos han
permitido
la caracterización de los eventos moleculares y celulares que
tienen lugar durante la transición
de preadipocitos indiferenciados tipo
fibroblastos hasta células grasas redondeadas maduras.
Las líneas celulares
utilizadas se pueden dividir en 3 categorías2: 1) células embrionarias
totipotentes capaces de generar todas las líneas celulares; 2) células
multipotentes que pueden
dar lugar a miocitos, adipocitos y condrocitos; 3)
células ya comprometidas hacia la línea
adiposa, que son las denominadas
líneas celulares de preadipocitos .
Los procesos de diferenciación
de adipocitos se han estudiado principalmente en estas
líneas celulares de
preadipocitos tales como 3T3-L1 y 3T3-F442A, las cuales fueron aisladas
por
clonaje desde células derivadas de embriones de ratones Swiss 3T38. La línea
TA1 se
estableció por el tratamiento de células fibroblásticas embrionarias
de ratón CH310T1/2 con el
agente demetilante 5-azacitidina9. La línea Ob1710
y sus derivadas se generaron desde
precursores adipocitarios presentes en la
grasa epididimal de ratones adultos genéticamente obesos (ob/ob).
Se ha logrado también el cultivo de preadipocitos primarios así como la inducción de su
transformación en adipocitos maduros en diversas especies
animales incluido el hombre.
Las células primarias son diploides y reflejan
mejor, por tanto, la situación in vitro que las líneas
celulares aneuploides.
Además, presentan la ventaja de que pueden ser obtenidas desde varias
especies a diferentes etapas del desarrollo postnatal y de diferentes
depósitos grasos. Esto último
es muy importante, ya que se han observado
importantes diferencias moleculares y bioquímicas
entre los distintos
depósitos grasos.
Durante la fase de crecimiento
tanto las líneas celulares de preadipocitos como los
preadipocitos primarios
son morfológicamente similares a los fibroblastos. Una vez que las
células
han alcanzado la confluencia, el tratamiento con los inductores adecuados de
la
diferenciación conduce a un cambio drástico en la forma de las células.
Los preadipocitos se
convierten en células de forma esférica que empiezan a
acumular lípidos, y que van
adquiriendo progresivamente las características
morfológicas y bioquímicas propias de los
adipocitos maduros.
El tratamiento capaz de inducir la diferenciación varía en los distintos modelos celulares descritos.
Aunque los preadipocitos de diferentes
fuentes son similares en múltiples aspectos, su
respuesta a los agentes
inductores de la diferenciación varía considerablemente. Estas
diferencias
pueden venir determinadas por el diferente estadío de maduración en el
que se
obtuvieron los preadipocitos7. En la mayor parte de los casos se
requiere la presencia
de insulina. En algunos casos, como por ejemplo en los
preadipocitos 3T3-L1, la
diferenciación se ve acelerada tras el tratamiento
durante 48 horas con
dexametasona, un corticoide; isobutilmetilxantina
(IBMX), un estimulante del AMPcíclico;
y altas concentraciones de insulina,
en presencia de suero bovino fetal. Tras este
periodo inductor de la
diferenciación, no se requiere la presencia de algunos de estos
inductores de
la diferenciación para el mantenimiento del fenotipo del adipocito maduro.
PROCESOS DE LA
DIFERENCIACIÓN DE ADIPOCITOS
La diferenciación de los
adipocitos es un proceso complejo en el que los preadipocitos
deben
interrumpir su crecimiento y salir del ciclo celular previamente a su
conversión
terminal en adipocitos. Este proceso de diferenciación supone
cambios cronológicos en
la expresión de numerosos genes. Así, se van
adquiriendo aquellos genes característicos
de los adipocitos, al mismo tiempo
que se van reprimiendo genes que son inhibitorios para
la adipogénesis o que
no son innecesarios para la función del adipocito maduro. Todos estos
cambios
en la expresión y función de estos genes conducen finalmente a la adquisición
del
fenotipo característico del adipocito12.
Aunque los fenómenos moleculares implicados en la diferenciación de los adipocitos no son
totalmente conocidos, se ha sugerido un modelo que incluye
varias etapas (se describe como
ejemplo el modelo de diferenciación propuesto
para la línea celular 3T3-L1):
1. Inhibición del
crecimiento
Una vez alcanzada la
confluencia, los predipocitos 3T3-L1 sufren inhibición por contacto y
cesan
su crecimiento, y comienzan a exhibir algunos de los marcadores tempranos de
la diferenciación.
2. Expansión clonal
El tratamiento de estas células
en las que ha cesado el crecimiento con medio de diferenciación
las induce a
reentrar en el ciclo celular, y se producen varias rondas de replicación de
DNA
y duplicación celular. Esta expansión mitótica clonal de células
comprometidas es
esencial para completar la diferenciación terminal en
adipocitos maduros. Las proteínas
del retinoblastoma (Rb) modulan la
actividad de E2F, un factor de transcripción que juega
un papel fundamental
en la regulación de la progresión del ciclo celular. Varios estudios
recientes
han sugerido que las proteínas Rb juegan un papel fundamental en la
regulación de la
expansión mitótica clonal necesaria para la diferenciación
de los adipocitos 3T3-L1.
3. Cambios tempranos en la expresión de genes
Conforme la expansión clonal
cesa, se inicia la activación transcripcional coordinada de genes
específicos
del adipocito. La expresión de estos genes se acompaña de cambios bioquímicos
y morfológicos dramáticos que conducen a la adquisición del fenotipo del
adipocito. La
expresión de lipoprotein lipasa (LPL) ha sido considerada a
menudo como un signo temprano
de la diferenciación adipocitaria. La expresión
de LPL ocurre, sin embargo, de manera
espontánea al alcanzar la confluencia y
es independiente de los inductores de la diferenciación.
Esta circunstancia
sugiere que LPL puede reflejar la etapa de cese del crecimiento más
que ser
un marcador temprano del proceso de diferenciación.
Hasta ahora, se han descrito dos familias de factores de transcripción, las C/EBPs
(CCAAT/Enhancer Binding Proteins) y PPARg (Peroxisome
Proliferator-Activated
Receptor g), que han sido identificadas como
“directores” reguladores de la transcripción de
genes adipogénicos.
La familia C/EBP está
constituida por varias isoformas15: C/EBPa, C/EBPb y C/EBPd.
C/EBPa
parece ser un factor nuclear indispensable y crítico en el proceso de
diferenciación de los
adipocitos. Varios estudios han puesto
de manifiesto que este factor de transcripción es no
sólo requerido, sino
también suficiente para poner en marcha el proceso de diferenciación de los
adipocitos incluso en ausencia de agentes inductores de la diferenciación16,18.
En apoyo de
esta hipótesis, se ha observado que la supresión de la expresión
de C/EBPa por un tratamiento
con antisentidos provoca una inhibición en la
diferenciación terminal de los adipocitos, lo cual
parece indicar que este
proceso requiere el mantenimiento de la expresión sostenida de C/EBPa .
Esta expresión de C/EBPa durante la etapa de diferenciación terminal se ha
atribuido
a un fenómeno de autoactivación de su propio gen, el cual contiene
un lugar de unión para
C/EBP en la región proximal de su promotor. Además, la
importancia de C/EBPa para la activación
de otros genes específicos del
adipocito maduro se pone también de manifiesto por la
identificación de
lugares de unión para C/EBPa en los promotores de varios de estos genes,
tales como aP2.
Sin embargo, el hecho de que
C/EBPa se active relativamente tarde en la secuencia de
eventos del proceso
de diferenciación (días 3-4) ha hecho surgir algunas cuestiones referentes
a
su papel de maestro director en este proceso. En este sentido, se ha
observado que la activación
de las isoformas b y d de la familia de las
C/EBPs es cronológicamente anterior a la de C/EBPa,
lo que sugiere que ambas
(b y d) juegan un papel preparatorio muy temprano en la cascada
de fenómenos
que conducen a la diferenciación17. Los niveles de C/EBPb y C/EBPd
se
ven incrementados en respuesta a la isobutilmetilxantina (IBMX) y la
dexametasona
respectivamente20, y su principal función es iniciar la
activación de C/EBPa, el cual es
finalmente responsable de la activación de
la serie de genes específicos de los adipocitos.
El PPARg es el único miembro de
una familia de receptores nucleares/factores de
transcripción (PPAR), que se
encuentra expresado en altos niveles específicamente en
tejido adiposo y que
se ha demostrado es un importante mediador del proceso adipogénico.
La expresión de PPARg antecede la inducción de C/EBPa en la cascada de
eventos
que conducen a la diferenciación de los adipocitos. Al
igual que lo observado con C/EBPa,
la expresión retroviral de PPARg es
suficiente para inducir la conversión de varias líneas celulares
de
fibroblastos en adipocitos21. En este sentido, se ha observado que
la coexpresión de PPARg
y C/EBPa en fibroblastos tiene un efecto sinérgico
sobre la inducción del proceso de conversión
en adipocitos.
Las tiazolidinedionas, fármacos
con acción antidiabética, actúan como ligandos directos de
PPARg, y se ha
observado que son, por tanto, potentes y efectivos estimulantes de la
adipogénesis.
Los factores de transcripción C/EBPb y C/EBPd parecen jugar
también un importante papel en
la inducción de PPARg. De hecho, su expresión
ectópica provoca un incremento en los
niveles de PPARg equivalente al de las
células adiposas normales24.
Otro factor que también parece estar implicado en el proceso de diferenciación es ADD1/SREBP1
(Adipocyte Determination Differentiation
Dependent Factor 1/ Sterol Regulatory Element Binding
Protein 1). La
coexpresión de este factor de transcripción incrementa la actividad
transcripcional
de PPARg incluso en ausencia de sus ligandos activadores.
Entre los genes que disminuyen su expresión a lo largo de la diferenciación es de destacar
Pref-1 (Preadipocyte Factor-1). Pref-1 presenta altos niveles
de expresión en preadipocitos
y su expresión disminuye durante la
diferenciación, siendo completamente indetectable en
adipocitos maduros.
4. Eventos tardíos y
diferenciación terminal
Durante la fase final de la
diferenciación, los adipocitos en cultivo incrementan marcadamente la
lipogénesis de novo, observándose, por tanto, un incremento en la expresión y
actividad de
enzimas implicados en esta ruta tales como la sintasa de ácidos
grasos, enzima málica,
glicerol 3-fosfato deshidrogenasa… Durante esta etapa
aumenta también considerablemente
la sensibilidad a la insulina, debido a un
gran aumento en el número de receptores de insulina y
transportadores de
glucosa dependientes de insulina (GLUT4).
La diferenciación de los
adipocitos conlleva una pérdida de receptores adrenérgicos b1, mientras
que
se produce un incremento de los b2 y b3, resultando un incremento total en el
número
de receptores adrenérgicos.
Además, se expresan y sintetizan también otros genes y productos específicos de los adipocitos
como aP2, una proteína fijadora de ácidos grasos específica
de adipocitos y perilipina, una
proteína asociada a las gotas de lípidos.
Además, los adipocitos en esta etapa comienzan
a secretar algunas sustancias
endocrinas y paracrinas tales como leptina, adipsina, PAI-1 y
la
angiotensina.
FACTORES QUE MODULAN LA
DIFERENCIACIÓN DE LOS ADIPOCITOS
Según lo expuesto hasta ahora
puede deducirse que la diferenciación de los adipocitos es
un proceso
altamente complejo, que se encuentra sometido a regulación por diferentes
hormonas y factores de crecimiento. La identificación de estos factores que
regulan
tanto positiva como negativamente el proceso de diferenciación
adipocitario, y el conocimiento
de las rutas implicadas, provee importante
información para una mejor comprensión de los
mecanismos moleculares
implicados en el proceso diferenciador.
EL TEJIDO ADIPOSO BLANCO COMO ÓRGANO DE ALMACENAMIENTO DE ENERGÍA
Lipogénesis
El tejido adiposo blanco es el mayor reservorio energético del organismo. La energía es almacenada
en las células grasas en forma de triglicéridos. La
principal fuente de triglicéridos para los adipocitos
procede de los
quilomicrones y las VLDL circulantes. Los triglicéridos de estas
lipoproteínas son
hidrolizados hasta ácidos grasos libres y monoglicerol por
la lipoproteína lipasa (LPL) que se
encuentra en la pared de los capilares
del tejido adiposo. Estos ácidos grasos libres son captados
por los
adipocitos a través de procesos de transporte activo mediado por proteínas
transportadoras
específicas de ácidos grasos. Una vez en el interior de la
célula, los ácidos grasos son reesterificados
para formar triglicéridos27.
Los ácidos grasos plasmáticos que circulan unidos a albúmina también
pueden
ser captados por los adipocitos y reesterificarse a triglicéridos.
El término lipogénesis de novo
designa específicamente la formación de ácidos grasos a partir de
algún
precursor derivado del adipocito, por ejemplo glucosa. En humanos, el
almacenamiento de los
ácidos grasos en el tejido adiposo depende
prácticamente de la liberación de los mismos desde las
lipoproteínas por
acción de la LPL27. Sin embargo, se ha observado que pacientes con
deficiencia
de LPL son capaces de acumular triglicéridos en el tejido adiposo28,
lo que hace pensar en la
implicación de otros mecanismos tales como la
lipogénesis de novo u otras rutas alternativas
como el sistema adipsina/ASP.
Lipólisis
Durante la lipólisis, los triglicéridos almacenados en el tejido adiposo son
hidrolizados hasta ácidos
grasos y glicerol. El paso limitante de la
lipólisis está controlado por la lipasa sensible a hormonas (HSL).
Esta
enzima cataliza la hidrólisis de triglicéridos hasta monoglicéridos.
Finalmente, éstos son
degradados por la monoacilglicerol lipasa. La HSL está
sujeta a una intensa regulación. Así, la HSL
se activa por fosforilación
controlada por la proteína quinasa A, la cual está asimismo activada
por la
vía del AMPcíclico (AMPc). La lipólisis se verá estimulada por todas aquellas
hormonas
que al unirse a su receptor provoquen la activación de proteínas G
estimulantes y, por tanto la
estimulación de la adenilatociclasa y la
formación de AMPc, como ocurre por la unión de
catecolaminas a los receptores
b-adrenérgicos. Por el contrario, la lipólisis va a ser inhibida por
aquellas
hormonas cuyo receptor se encuentra asociado a la adenilato ciclasa a través
de proteínas G
inhibitorias. Esto provoca una menor producción de AMPc y una
menor activación de la proteína
quinasa A y por tanto de la HSL. Es lo que
ocurre tras la activación por catecolaminas de
receptores a2-adrenérgicos y
receptores de adenosina. Las catecolaminas tienen, por tanto, un efecto
dual
sobre la lipólisis y, por ello, su efecto lipolítico neto depende del balance
entre receptores a y b
adrenérgicos. Otras hormonas inhibidoras de la
lipólisis como es el caso de la insulina, actúan a través
de receptores que
están asociados a la fosfatidilinositol quinasa 3 (PIK-3), cuya activación
provoca
asimismo la de la fosfodiesterasa III (PDE III) que cataliza la
inactivación de AMPc a 5’AMP.
Además, parece existir un ritmo basal de
lipólisis que es independiente de hormonas.
Metabolismo del tejido
adiposo y distribución de los depósitos grasos
La mayor o menor acumulación de
grasa en unas zonas que en otras del organismo viene
determinada por las
variaciones regionales en el balance entre los procesos de movilización
o
almacenamiento lipídico. En este sentido, mientras que las mujeres suelen
presentar
una acumulación preferentemente periférica de la grasa, los hombres
suelen presentar una
distribución central o abdominal. Este proceso parece
ser debido a que en las mujeres están más
acentuados que en el hombre los
procesos que favorecen la movilización lipídica en los depósitos de
grasa
viscerales y los que facilitan el almacenamiento de lípidos en los tejidos
periféricos subcutáneos
grasos. También en situaciones de
obesidad se observan sujetos con obesidad periférica y sujetos
con obesidad
abdominal. Es esta última la que está relacionada con el desarrollo de
complicaciones
metabólicas y cardiovasculares, lo que podría estar causado
porque las diferencias regionales en la
lipólisis entre la grasa visceral y
subcutánea son más marcadas en personas con obesidad abdominal,
presentando
una menor respuesta lipolítica a catecolaminas en la grasa subcutánea
abdominal y una
estimulación de la actividad lipolítica en la grasa visceral.
El incremento en ácidos grasos libres derivado
del aumento en el tamaño y la
actividad lipolítica de la grasa visceral parece ser el responsable de las
alteraciones metabólicas hepáticas, que conducen finalmente a
hipertrigliceridemia, hiperinsulinemia,
resistencia a la insulina,
etc.
EL TEJIDO ADIPOSO BLANCO COMO ÓRGANO SECRETOR
Estudios de los últimos años ha puesto de manifiesto la gran importancia del
tejido adiposo blanco como
productor de ciertas sustancias con acción
endocrina, paracrina y autocrina. En este grupo de sustancias
secretadas por
el tejido adiposo se encuentran moléculas implicadas en la regulación del
peso corporal
(leptina, Acrp30/adipoQ), sustancias relacionadas con el
sistema inmune (TNFa, IL-1, IL-6), la función
vascular (angiotensina e
inhibidor del activador del plasminógeno tipo 1), el desarrollo de la
resistencia a
la insulina (resistina) y la función reproductora (estrógenos),
entre otras.
Leptina Es una hormona segregada principalmente por los adipocitos que juega un importante papel en la regulación
del peso corporal a través de sus efectos
centrales sobre el apetito y periféricos sobre el gasto energético.
Los
niveles de leptina circulantes están directamente relacionados con la
adiposidad, pero ésta no es el
único factor determinante de los niveles de
leptina. Por ejemplo, la concentración de leptina circulante
disminuye en
condiciones de ayuno o restricción calórica y aumenta en respuesta a la
ingesta. En este sentido,
se ha postulado que el metabolismo de la glucosa es
el principal determinante de la secreción de
leptina tanto in vitro como in
vivo.
Citoquinas (TNFa, IL-1, IL-6)
Estas moléculas multifuncionales son producidas por muchos tipos celulares
incluidos los adipocitos.
Respecto a la función que llevan a cabo estas
citoquinas secretadas por el tejido adiposo, se ha
sugerido una acción
paracrina o autocrina en el propio tejido. Los niveles del TNFa en tejido
adiposo
están correlacionados positivamente con el tamaño de los depósitos
adiposos. El TNFa es un estimulante
de la lipólisis, mientras que inhibe la
expresión de LPL y GLUT4, dos elementos claves para la
acumulación de
lípidos, por lo que podría considerarse como un mecanismo que trata de
reducir el
tamaño excesivo de los depósitos grasos. Sin embargo, estos altos
niveles de TNFa en tejido adiposo
podrían estar implicados en el desarrollo
de algunas alteraciones metabólicas tales como la resistencia
a la insulina. En
este sentido, se ha demostrado que el TNFa inhibe la captación de glucosa
dependiente
de insulina ya que interfiere con la ruta de señalización de la
misma. El papel que en el ámbito fisiológico
general pudieran tener estas
citoquinas secretadas por el tejido adiposo no está claro.
Adipsina/ASP La ASP (Acylation Stimulating Protein) es una proteína sérica relativamente pequeña, idéntica a
C3adesArg, el producto inicial de la activación de la vía
alternativa del complemento. La molécula
de ASP se genera a través de la
interacción de un complejo de proteínas entre las cuales se incluye
la
adipsina, de ahí que al sistema se le denomine “adipsina/ASP”. El papel de la
ASP parece ser regular
el ritmo al cual los ácidos grasos procedentes de la
acción de la LPL son captados por los adipocitos y posteriormente convertidos
a triglicéridos por los mismos. La ASP también parece afectar el ritmo al
que
los ácidos grasos son liberados desde los adipocitos. Se ha sugerido, por
tanto, que la insulina
y la ASP interaccionan en los procesos de regulación
de almacenamiento y movilización energética.
Acrp30/AdipoQ/Adiponectina La Acrp30 (Adipocyte Complement Related Protein), también conocida como AdipoQ, adiponectina,
apM1, es una proteína expresada exclusivamente en adipocitos
diferenciados. Su función no está clara
todavía, pero se ha observado que sus
niveles de ARNm están disminuidos en animales y humanos
obesos. Un estudio
reciente ha mostrado que un producto resultante de la ruptura proteolítica de
Acrp30, en concreto el correspondiente al dominio globular C-terminal
incrementa la oxidación de
ácidos grasos en el músculo y causa pérdida de
peso en ratones que consumían una dieta alta en grasa sin afectar al apetito.
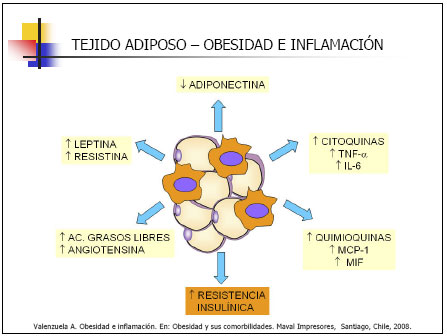 Recientemente, se ha identificado una nueva molécula, la resistina, secretada por adipocitos maduros y que se ha postulado podría ser el enlace entre la obesidad y el desarrollo de resistencia a la insulina. De hecho, se ha observado que los niveles circulantes de resistina están aumentados tanto en modelos genéticos como dietéticos de obesidad, y que el tratamiento con las tiazolidinedionas, fármacos antidiabéticos agonistas de PPARg, disminuye los niveles circulantes de resistina. Además, la administración de un anticuerpo antiresistina a ratones con obesidad inducida por la dieta mejora los niveles sanguíneos de glucosa e insulina. Sin embargo, un estudio posterior ha observado que la expresión de resistina en tejido adiposo está severamente disminuida en la obesidad y que es estimulada por los agonistas PPARg. Se requieren, por tanto, nuevos estudios para determinar el papel de esta molécula tanto en la obesidad como en la resistencia a la insulina. El tejido adiposo posee algunos de los principales componentes del sistema renina-angiotensina. El angiotensinógeno puede jugar un papel importante en la regulación del aporte sanguíneo al tejido adiposo y el flujo de ácidos grasos desde el mismo. Además, se ha observado que la expresión génica de angiotensinógeno está aumentada en obesidad en humanos. La angiotensina II posee un efecto estimulante sobre la diferenciación del tejido adiposo y parece estar implicada en la regulación de la adiposidad debido a sus acciones lipogénicas. mismo en la grasa visceral que en la grasa subcutánea, lo cual podría relacionarse con el incremento en los niveles de PAI-1 observados en la obesidad central y con el desarrollo de las alteraciones vasculares asociadas a la misma. |
No hay comentarios:
Publicar un comentario